生物制品的分析测试方法开发和验证
Analytical Test Procedure Development and Validation: Approach for Biologics
课程形式
课堂式课程
举办城市
上海
课程时间
2018-09-19 至 2018-09-20
报名截止
2018-09-14
课程分类
生物
作为美国药典委员会全新推出的生物制品和生物技术类药典培训课程,课程全面介绍生物制品分析测试的方法开发(分析控制策略)、方法性能、方法验证的关键环节。课程结合案例分析对方法开发进行详细介绍,通过系统适用性案例来阐述方法性能的重要性,并帮助学员熟悉美国药典与生物制品分析相关通则,详细介绍美国药典通则<1225>方法验证的具体要求。同时,课程以美国药典委员会生物实验室的相关案例为基础详细介绍如何评估及选择验证参数。通过学习,您将了解有关生物样本分析的方法开发基本原理,使用合适的系统适用性来评估方法性能的重要性,识别开发生物制品系统适用性样品及分析方法可接受标准的关键考量,以及生物制品分析方法的验证与验证参数评估的关键点。
学习目的
通过学习,您将了解以下内容:
• 生物样本分析的方法开发基本原理
• 使用合适的系统适用性来评估方法性能的重要性
• 识别开发生物制品系统适用性样品及分析方法可接受标准的关键考量
• 生物制品分析方法的验证与验证参数评估的关键点
课程为从事生物制品分析方法开发和验证工作的科研人员、主管、经理、监管或审查方面的专业人士设计,包括分析人员、研发人员、QC人员、QC和研发经理、CRO/CMO人员等。
授课语言
英文(提供中文口译)
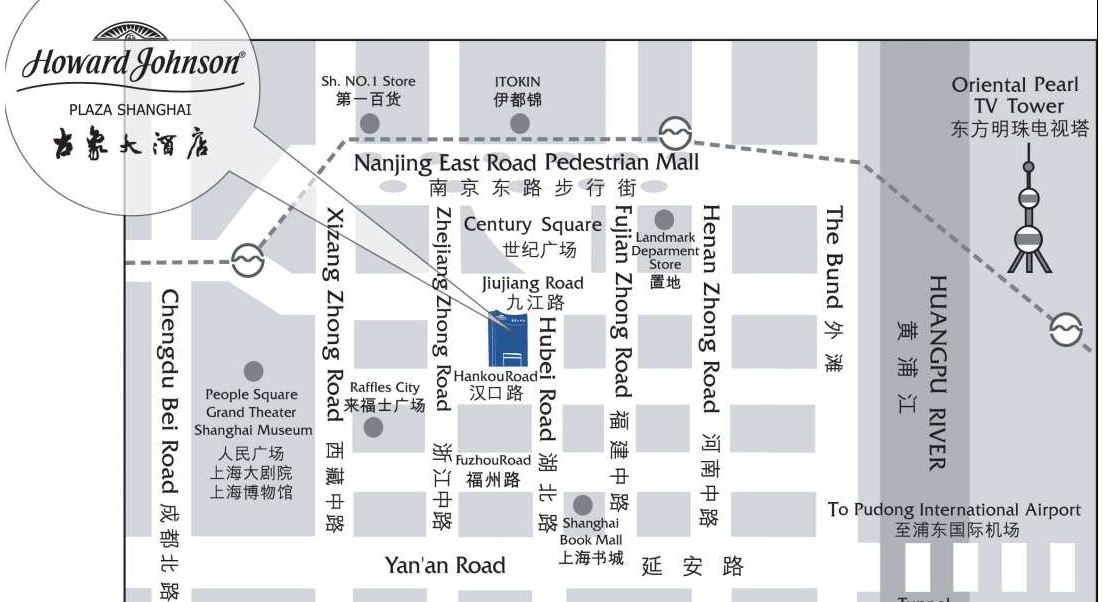
古象大酒店位于上海市中心最繁华的金融、商业、购物区南京东路步行街附近,
外滩、人民广场等上海都市景点尽在百步之遥,地铁及其它交通枢纽信步可达。
交通路线:
地铁1、2、8号线人民广场站下(14号出口),步行5分钟左右。
-
Krishna Menon 博士美国药典委员会印度分部全球生物制品部门高级科学与标准事务联络人
作为美国药典委员会印度分部生物制品部门高级科学与标准事务联络人,Menon 博士主要负责生物制品各论和标准物质开发工作。她在加入USP-India 之初担任生物制品和生物技术实验室总监,负责生物实验室设备、能力、技术团队的筹建。2011-2013年间,她负责8-10个蛋白和疫苗各论开发的管理工作。
Menon 博士拥有近15年生物药行业工作经验。2003-2010年,Menon 博士曾任职于印度Intas生物制药公司,领导35人团队从事治疗性从组蛋白的分析开发、产品特性和验证工作,参与了6个生物产品的成功商业化进程,并共同领导开发了用于欧洲市场的第一个印度生物类似药非格司亭。此外,Menon 博士带领团队成功完成了多个向美国和欧洲客户提供的产品开发和技术转移项目。Menon 博士拥有印度巴罗达大学微生物博士学位,在日本大阪大学和美国加州柏克莱大学完成分子生物学博士后工作。

2,500 元人民币 /
2,500 RMB /
2,500 RMB /
费用包含培训费、资料费、日程表中提及的餐饮费;其它费用自理(如差旅费)。
报名人数优惠:
报名人数超过 2 人,超出人数名额部分可享受减免
20%
优惠折扣
其他优惠政策:
政府药检系统或科研院校,享受20%折扣。
参会费用: